Equilibrio acido base
L'equilibrio acido-base indica un complesso meccanismo fisiologico che consente all'organismo di mantenere il pH tra valori di 7,35 e 7,45, consentendogli di svolgere in modo ottimale le proprie funzioni metaboliche.
Aspetti generali
[modifica]L'organismo umano è costituito in massima parte da acqua in cui sono disciolte svariate sostanze. La concentrazione degli ioni idrogeno H+, ossia tecnicamente protoni disciolti in soluzione, conferisce maggiore o minor acidità. Questi ioni si legano alle molecole di acqua H2O formando ioni idronio H3O+. La misurazione della concentrazione degli ioni idrogeno consente pertanto di valutare il grado di acidità della soluzione. Per semplificare i calcoli si utilizza come valore il pH (dal francese pouvoir + Hydrogene, "potere dell'idrogeno").
Il pH si definisce come il logaritmo negativo in base 10 della concentrazione di ioni di idrogeno libero in moli per litro:
Nell'acqua pura la quantità di protoni H+ è perfettamente pari e bilanciata da quella degli anioni OH-, di segno opposto. Per entrambi gli ioni la concentrazione è di 10−7 moli per litro per cui il pH dell'acqua pura corrisponde a –log (10-7) ossia al log107, quindi a 7.
Se in una soluzione prevalgono gli ioni + (per aggiunta di acidi o sottrazione di basi) essa diventerà acida ed il suo pH si abbasserà a valori che vanno da meno di 7 (acido debole) a 1 (acido forte). Al contrario, il prevalere degli anioni comporterà la trasformazione basica della soluzione con un innalzamento del pH, a valori che andranno da più di 7 (base debole) a 14 (base forte).
La reazione del plasma è normalmente alcalina con un pH di 7,41. L'urina ha normalmente reazione debolmente acida intorno a 6 e può variare da 4,4 (acidità) a 8 (basicità debole) in ragione delle sostanze escrete.
L'organismo produce quotidianamente per sua stessa natura considerevoli quantità di acidi attraverso vari processi (basti pensare alla respirazione cellulare, che genera CO2 la quale viene convertita in acido carbonico). Gli acidi che possono essere espulsi dall'organismo tramite la respirazione polmonare vengono definiti volatili, ad esempio l'acido carbonico (che viene riconvertito a CO2 a livello dei capillari polmonari, questa diffonde negli alveoli); invece parliamo di acidi non volatili se la loro eliminazione avviene in altro modo, come nel caso dell'acido solforico prodotto dal metabolismo di metionina e cisteina, dell'acido urico prodotto dal metabolismo delle nucleoproteine e degli acidi organici prodotti dall'ossidazione incompleta dei grassi, i quali vengono solitamente escreti nelle urine.
Il corpo umano è dotato essenzialmente di tre meccanismi che permettono di controllare attivamente la concentrazione di idrogenioni (e conseguentemente il pH):
- sistemi tampone dei liquidi;
- controllo della respirazione, la quale permette di eliminare gli acidi volatili;
- eliminazione degli acidi o delle basi in eccesso per via renale.
Ognuno di questi meccanismi ha un proprio tempo di attivazione: se per i sistemi tampone la risposta è immediata, l'attivazione del centro del respiro richiede invece un maggior lasso di tempo, e la regolazione per via renale un tempo ancora maggiore.
Valori di riferimento
[modifica]I valori fisiologici riscontrabili negli esami ematologici sono:
- pH = 7,35-7,45
- PaCO2 = 35-45 mmHg
- HCO3- = 22-26
- Cl- sierico = 95-105 mEq/l
- Na+ sierico = 135-145 mEq/l
- K+ sierico = 3,3-4,9 mEq/l
- Anion gap = Na+-(HCO3-+Cl-) = 12 +/-4
In base a questi valori, possiamo anche ricavare:
- delta PaCO2 = PaCO2 attuale-PaCO2 di riferimento
- delta HCO3- = HCO3- attuale - HCO3- di riferimento
- delta anion gap = anion gap attuale-anion gap di riferimento
- compenso atteso = compenso che noi ci aspettiamo e che può essere calcolato in termine di modifica di HCO3-- o di PaCO2.
Considerazioni alla base del compenso acido base
[modifica]Come ben sappiamo, la respirazione tissutale è caratterizzata da:
- apporto di ossigeno dai polmoni ai tessuti ottenuto con il trasporto, nel sangue, di emoglobina che lega l'O2;
- trasporto di CO2 dai tessuti ai polmoni (e qui l'escrezione con l'espirazione) ottenuti per lo più idratando la CO2, producendo acido carbonico H2CO3 (che si dissocia in HCO3- + H+) e successivamente viene scisso negli alveoli in CO2 + H2O (vedi formula 2).

I bicarbonati sono utili soprattutto in quanto rappresentano il "mezzo di trasporto" che permette di far arrivare la CO2 ai polmoni affinché venga espulsa, ma anche perché essendo prevalentemente presenti come ioni bicarbonato dato il pK corporeo, permettono un controllo della concentrazione di idrogenioni legandosi ad essi e formando acido carbonico.
Fondamentalmente il mantenimento del pH nel range di normalità è funzione di una normale PaCO2 (circa 40 mmHg) e di una normale quantità di bicarbonati (circa 24 mEq/litro). La PaCO2 si modifica al variare della funzione respiratoria, come l'HCO3- si modifica in base alla funzionalità del rene. Ne consegue che l'attività respiratoria e quella renale sono fondamentali nella omeostasi dell'equilibrio acido base. La formula
(formula 2)
illustra questo concetto: in pratica la CO2 ematica viene idratata ad acido carbonico (H2CO3), il quale si scinde in H+ e HCO3-.
Questa reazione è catalizzata dall'enzima anidrasi carbonica, che è presente nei globuli rossi e in vari distretti corporei: pertanto nella parete alveolare (povera di CO2) si catalizza la reazione verso sinistra, ovvero: H2CO3 → CO2 + H2O, con liberazione della CO2 nell'aria; nella periferia, ove la CO2 è elevata, si ha una reazione opposta, ovvero CO2 + H2O → H2CO3, con neutralizzazione della H2CO3 che viene trasportata ai polmoni (per essere eliminata con l'espirazione).
Questa reazione avviene in realtà nei due sensi: esiste infatti un equilibrio dinamico tra l'acido carbonico H2CO3 e l'anidride carbonica CO2 da una parte (insieme all'H2O) e gli ioni bicarbonato HCO3- e H+ dall'altra. Ogni variazione degli ioni di idrogeno e bicarbonato o dell'anidride carbonica determinano una alterazione di questo equilibrio con spostamenti a sinistra o a destra, che dovranno essere corretti dall'apparato respiratorio (che con un aumento della ventilazione smaltirà la quantità eccedente di CO2) e dall'apparato renale (che aumenterà o ridurrà la eliminazione degli ioni H+ e HCO3-).
In parole povere, se aumenta l'acidità il conseguente aumento di H+ provoca una reazione da destra a sinistra con aumento della CO2 che viene eliminata dai polmoni.
Se aumenta la alcalinità, ovvero diminuiscono gli ioni H+, si ha una reazione (vedi formula 2) da sinistra a destra con diminuzione dell'eliminazione di CO2.
Meccanismi tampone
[modifica]Il metabolismo dell'organismo umano deve quindi mantenere costantemente in equilibrio il pH, attraverso alcuni principali meccanismi tampone.
Tampone bicarbonato
[modifica]Ha come base la formula . Si tratta del più importante sistema tampone, nonostante un pK=6.1.
Gli idrogenioni in eccesso si legano agli ioni bicarbonato circolanti, formando acido carbonico. Questo una volta raggiunti i capillari polmonari viene scisso dall'anidrasi carbonica in acqua e CO2, la quale diffonde negli alveoli e viene espulsa con l'espirazione.
Permette l'escrezione degli ioni H+ in eccesso attraverso le urine: i bicarbonati vengono a seconda delle necessità riassorbiti a livello del tubulo renale, o espulsi come CO2 attraverso la respirazione.
Tampone fosfato
[modifica]Si basa sulla formula (formula 3). Rappresentato dalla coppia , contribuisce grazie alla seconda reazione di dissociazione dell'acido la quale ha pk=7.2. Importante sia a livello intracellulare (dove il fosfato essendo implicato in varie reazioni è piuttosto presente) che a livello renale (in quanto il liquido tubulare ha un pH generalmente vicino al pK del fosfato. Lo ione ortofosfato viene escreto nelle urine, mentre lo ione bicarbonato viene riassorbito: nella pratica legano gli H+ e li eliminano nelle urine, divenendo il principale sistema tampone a livello renale).
Proteine
[modifica]Rappresentano il sistema tampone più esteso dell'organismo: le proteine (sia extracellulari che intracellulari) tamponano gli idrogenioni in eccesso grazie ai loro residui aminoacidici contenenti gruppi carbossilici (con pK=6.4-7) come nell'istidina e gruppi α-aminici (pK=7.4), grazie alla reazione
(formula 4)
Lo ione bicarbonato viene riassorbito, mentre l'altro ione viene escreto nelle urine, similmente a quanto avviene coi fosfati.
Emoglobina
[modifica]L'emoglobina è capace di legare idrogenioni in maniera autonoma, ed è presente nella forma HbH e Hb-. Per quanto le capacità tampone dell'emoglobina non siano quelle più importanti dal punto di vista della regolazione globale del pH, esse vanno considerate in quanto le capacità dell'emoglobina di rilasciare l'ossigeno dipendono dal suo stato di protonazione, e l'emoglobina provvede a tamponare autonomamente lo ione H+ rilasciato a seguito della conversione dell'idratazione dell'anidride carbonica ad acido carbonico da parte dell'anidrasi carbonica presente negli eritrociti.
Meccanismi di compenso
[modifica]Compenso respiratorio
[modifica]In condizioni fisiologiche abbiamo un pH=7.4 e una pCO2=40mmHg.
Come già accennato la respirazione permette un certo grado di controllo del pH: un eccesso di acidi (e conseguentemente un calo del pH, ovvero un'acidosi) tenderà fisiologicamente a riportare l'equazione precedente verso sinistra, e la frequenza respiratoria aumenterà per poter espellere una maggiore quantità di CO2. Viceversa, ad un aumento del pH globale (alcalosi) indurrà una riduzione della frequenza respiratoria.
Il controllo del pH da parte dell'apparato respiratorio origina dai chemocettori presenti a livello centrale nel bulbo ventrale e in periferia a livello dei glomi carotidei e aortici. In seguito ad una variazione del pH essi inviano impulsi ai centri del respiro localizzati nel ponte e nel midollo allungato, che vengono stimolati o depressi a seconda delle necessità.
Esiste anche un controllo volontario della respirazione, i cui impulsi originano dalla corteccia e attraverso i fasci cortico-spinali arrivano ai muscoli coinvolti nella respirazione: tuttavia il controllo volontario della respirazione il più delle volte non è sufficiente a modificare in maniera apprezzabile l'equilibrio acido-base.
Compenso renale
[modifica]I reni svolgono un importantissimo ruolo nel mantenimento dell'equilibrio in due modi:
- eliminando direttamente ioni H+ per via urinaria;
- provvedendo al riassorbimento degli ioni bicarbonato.
Le cellule che contornano il tubulo contorto prossimale presentano sul lato del lume una pompa Na+/H+, che espelle nel lume idrogenioni e porta all'interno del citoplasma il sodio. L'ambiente acido che si viene a creare all'interno del lume tubulare e l'interazione degli idrogenioni con i bicarbonati che il glomerulo ha precedentemente filtrato porta alla formazione di acido carbonico: l'anidrasi carbonica presente sulle pareti tubulari determina la formazione di acqua e CO2, la quale semplicemente diffonde verso il citoplasma cellulare, e si reidrata ad acido carbonico che a sua volta produce un idrogenione ed uno ione bicarbonato. Si viene pertanto a creare una differenza di pH tra lume (acido) e citoplasma (basico).
A questo punto lo ione bicarbonato citoplasmatico viene espulso verso i capillari peritubulari da un sistema a cotrasporto con il sodio (sistema che permette peraltro di mantenere bassa la concentrazione di sodio nel citoplasma, aumentando il gradiente e facilitando il lavoro dello scambiatore Na+/H+, nonché abbassando i livelli di bicarbonato aumentando anche il gradiente per facilitare la diffusione dell'anidride carbonica dal lume.
Pressoché tutti i bicarbonati inizialmente filtrati attraverso il nefrone vengono riassorbiti: infatti come detto sopra il riassorbimento di bicarbonati è correlato alla secrezione di H+, ma anche (parzialmente) modulato da K+ e PaCO2. Un aumento di CO2 incrementa quindi il riassorbimento di HCO3- e viceversa. La disidratazione accresce il riassorbimento di HCO3- e viceversa.
In questo meccanismo è coinvolto anche il sistema tampone fosfato: gli ioni filtrati dal glomerulo si legano agli ioni H+ ivi presenti, formando . Ne deriva che ogni fosfato che accetta un idrogenione permette la "formazione" di uno ione carbonato, che non dovrà accettarne per formare acido carbonico: in tal modo si fa a ridurre la concentrazione di quest'ultimo spostando conseguentemente il gradiente verso la formazione di CO2, che come detto poi viene riassorbita nel citoplasma cellulare.
Equazione di Henderson-Hasselbach
[modifica]Come sappiamo, il pH viene calcolato in base alla concentrazione di ioni H+:
ovvero, il pH è inversamente proporzionale alla quantità di idrogenioni: maggiore la loro quantità, minore sarà il pH (che quindi sarà acido).
Riesumando vecchie nozioni di chimica, ricordiamo anche che la costante di dissociazione di un acido generico HA (ovvero il rapporto tra la concentrazione della sua forma dissociata con quella della forma indissociata) viene calcolata tramite la formula:
Considerando il relativo logaritmo in base 10 abbiamo
e sfruttando le proprietà dei logaritmi otteniamo
che corrisponde a
Rimaneggiando quest'ultima formula otteniamo infine
che rappresenta la cosiddetta equazione di Henderson-Hasselbach, la quale viene utilizzata per calcolare il pH di una soluzione tampone. Ad esempio, prendendo in considerazione l'acido carbonico abbiamo
Dal punto di vista clinico al posto della concentrazione di ioni bicarbonato possiamo utilizzare direttamente la pressione parziale di CO2 (trattandosi di due valori direttamente collegati) tramite l'equazione:
dove rappresenta la costante di Henry per l'anidride carbonica, pari a 298.15 mol/kg*bar. Pertanto al fine di calcolare il pH del sistema tampone in oggetto otteniamo
(formula 5)
ovvero per ogni aumento di PaCO2 dovremo avere un reciproco aumento di HCO3- e viceversa, se vogliamo mantenere costante il pH.
Diagramma di Davenport
[modifica]Supponiamo di effettuare un prelievo di sangue venoso ad un paziente. Analizzando i relativi parametri rinveniamo un pH=7.4, una PCO2 pari a 40mmHg e una concentrazione di ioni HCO3- pari a 24meq/L. Andiamo quindi a riportare tali valori su un grafico, ponendo il ascissa il pH e in ordinata la concentrazione di ioni bicarbonato:

Immaginiamo ora di aggiungere al campione ematico un acido forte e successivamente una base forte, mantenendo la pressione parziale di anidride carbonica costante: otterremo a quel punto la curva di titolazione del campione.

A questo punto, decidiamo di andare oltre. Supponiamo di variare la pressione parziale di CO2 e di eseguire un prelievo ad ogni variazione: esponiamo poi ogni campione ottenuto ad un acido forte e ad una base forte (mantenendo per ognuno la relativa pressione in maniera costante). Otterremo così varie curve di titolazione:
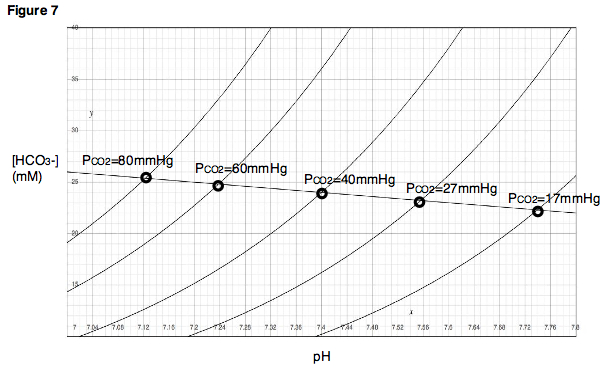
Si può notare come ad ogni aumento della pressione parziale di anidride carbonica corrisponda un lieve aumento della concentrazione di ioni bicarbonato ed un calo del pH (dato che gli ioni bicarbonato rilasciano idrogenioni liberi), mentre ad una riduzione della pressione parziale corrisponde un calo degli ioni bicarbonato ed un aumento del pH: tali variazioni seguono una linea retta pressoché perfetta. Da ciò si evince lo stretto rapporto tra pressione di CO2 e concentrazione di ioni bicarbonato, che sono in equilibrio tra loro, e i cui parametri si modificano in maniera lineare.
Il grafico ottenuto viene definito diagramma di Davenport, e permette di studiare le variazioni di pH e concentrazione di ioni bicarbonato legate a modificazioni della pCO2 (ovvero in termini clinici a variazioni respiratorie -ipoventilazione o iperventilazione- e/o metaboliche dell'equilibrio acido-base). Dal punto di vista pratico, non è altro che una rappresentazione grafica dell'equazione di Henderson-Hasselbach.
Approccio clinico all'equilibrio acido base
[modifica]Poniamo il caso di una persona diabetica che giunga in Pronto Soccorso con febbre e dispnea. I valori che riscontriamo sono: PaCO2 35 mmHg, HCO3- 17 mEq/L, glicemia 523 mg/L. Secondo l'equazione di Henderson-Hasselbach si ha:
(formula 5)
quindi nel caso specifico avremo un pH = 7,30.
Successivamente si ha un peggioramento del paziente per aggravamento della dispnea. All'EGA si ottiene PaCO2 51, HCO3-> 19, glicemia 387 ed un pH = 7,20.
Per mantenere un pH stabile quando uno degli elementi della formula di Henderson-Hasselbach si riduce anche l'altro deve fare lo stesso, e viceversa. Per esempio se aumenta la PaCO2 deve aumentare i bicarbonati ( come nel caso della BPCO). Se non è così siamo dinnanzi ad un disturbo misto. In corso di acidosi od alcalosi l'organismo tende a riportare il pH nei range normali, per mezzo di meccanismi di compenso.
Il compenso non è mai completo (per cui il pH non si normalizza mai completamente). Unica eccezione è l'alcalosi respiratoria cronica ove il PH rientra nella norma e si può parlare di compenso raggiunto (ricordiamo che il compenso atteso è il compenso che noi ci aspettiamo e che può essere calcolato in termine di modifica di HCO3- o di PaCO2).
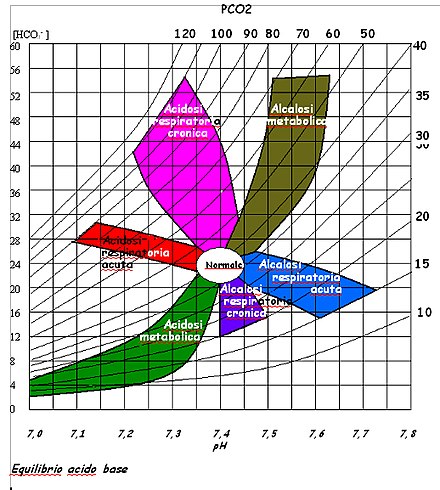
Ciò detto, possiamo riassumere le alterazioni dell'equilibrio acido-base in quattro tipologie:
- Acidosi respiratoria acuta: per 10 mmHg di aumento di PaCO2, si ha aumento di 1 mEq/l di HCO3-;
- Acidosi respiratoria cronica: per 10 mmHg di aumento di PaCO2, si ha aumento di 4 mEq/l di HCO3-;
- Alcalosi respiratoria acuta: per ogni 10 mmHg di riduzione di PaCO2, si ha calo di 2 mEq/l di HCO3-;
- Alcalosi respiratoria cronica: per 10 mmHg di riduzione di PaCO2, si ha un calo di 5 mEq/l di HCO3-.
Ricordarsi sempre che:
- il compenso respiratorio (iper o ipoventilazione) è immediato;
- il compenso renale richiede alcuni giorni prima di essere efficace.
Ciò comporta che le acidosi od alcalosi respiratorie vengono ulteriormente suddivise in croniche od acute.
Se (con l'unica eccezione dell'alcalosi respiratoria cronica) c'è un'alterazione di CO2 e HCO3 con pH normale, siamo dinnanzi ad un disturbo misto.
Acidosi respiratoria
[modifica]
Poniamo il caso di un ragazzo che viene trovato in un vicolo in stato di incoscienza. Ad una rapida analisi rinveniamo i seguenti parametri:
Pressione arteriosa sistolica: 80mmHg, frequenza respiratoria 10/min, pH 7.10, PaCO2 93 mmHg, PaO2 35 mmHg, HCO3- 29, K 3.8 mEq/L, Na 139 mEq/L, Cl 98 mEq/L.
È un disordine dell'equilibrio acido base per cui si ha un aumento di PaCO2 ed un calo del pH. Può essere acuto o cronico.
In fase acuta partecipano a tamponare il pH fosfati, proteine, emoglobina. Successivamente si ha un riassorbimento renali di bicarbonati con un effetto tampone più efficace (che tuttavia necessita di alcuni giorni)
Ricordiamo che nell' acidosi respiratoria acuta per ogni 10 mmHg di aumento di PaCO2, si ha aumento di 1 mEq/l di HCO3-, mentre nell'acidosi respiratoria cronica per ogni 10 mmHg di aumento di PaCO2 si ha aumento di 3-4 mEq/l di HCO3-.
Ad esempio (come nel caso sovracitato) un tossicodipendente con acidosi respiratoria acuta da ipoventilazione potrebbe avere pH 7,10, PaO2 35, PaCO2 93, HCO3- 29.
In un bronchitico cronico invece con acidosi respiratoria cronica si potrebbe avere: pH 7,35, PaO2 35, PaCO2 70, HCO3- 36, PaO2 45.
Tipicamente, nella grave insufficienza respiratoria da edema polmonare acuto nella rianimazione cardiopolmonare, nella insufficienza respiratoria acuta su un quadro di insufficienza respiratoria cronica (ad esempio polmonite su BPCO) l'acidosi è mista (respiratoria + metabolica da intossicazione di acido lattico).
| pH | PaCO2 | HCO3- | |
|---|---|---|---|
| Acidosi respiratoria acuta o cronica | basso | alto | normale o alto |
Alcalosi respiratoria
[modifica]
Un uomo con agitazione da un giorno giunge ad un P.S. con i seguenti valori: frequenza respiratoria 25/min, pH 7.55, PaCO2 24 mmHg, PaO2 100 mmHg., HCO3- 21, k. 3.2mEq/L, Na 139 mEq/L., Cl 98 mEq/L, compenso atteso HCO3 = Delta PaCO2 = 16 , quindi 1,6 x 2 = 3,2 di Delta HCO3-. Trattasi di alcalosi, con ipocapnia da iperventilazione e con piccola correzione dei bicarbonati, ovvero alcalosi respiratoria acuta pura, non mista.
È un disordine dell'equilibrio acido base per cui si ha una diminuzione di PaCO2 ed un aumento del pH. Il compenso acuto è scarso, a carico dell'emoglobina e non valutabile all'emogasanalisi. Il compenso cronico è a carico del rene Il meccanismo di compenso prevede che nell'alcalosi respiratoria acuta per ogni 10 mmHg di riduzione di PaCO2 si ha consumo di 2 mmHg di HCO3-, mentre nell'alcalosi respiratoria cronica per 10 mmHg di riduzione di PaCO2 si ha un consumo di 5 mmHg di HCO3-.
| pH | PaCO2 | HCO3- | |
|---|---|---|---|
| Alcalosi respiratoria acuta o cronica | alto | basso | normale o basso |
Alcalosi metabolica
[modifica]
Una donna con vomito incoercibile (successivamente inq rata come occlusione intestinale alta) giunge in P.S. disidratata, confusa, astenica. All'EGA avremo: pH: 7.5, PaCO2: 47, HCO3- 38, Na 136 mEq/L, K 2,7 mEq/L.
Il pH è elevato per cui si tratta di una alcalosi, la CO2 è lievemente aumentata (a causa dell'ipoventilazione, come conseguenza del compenso respiratorio) ed i bicarbonati sono elevati, per cui l'alcalosi è metabolica.
Il compenso sarà respiratorio per mezzo della diminuzione dei ventilazione. Nella pratica il compenso sarà immediato, quindi il vettore del rapporto pH/HCO3, dell'immagine, sarà unico come sommatoria dei due vettori separati.
Regola del compenso: per 10 mEq/L di aumento di HCO3-, si ha un aumento di 5 mmHg di CO2.
| pH | PaCO2 | HCO3- | |
|---|---|---|---|
| Alcalosi metabolica | alto | alto | alto |
Acidosi metabolica
[modifica]
Un uomo di 47 anni, alcolista, giunge in P.S. per stato soporoso (che risultera' poi avere una perforazione intestinale), disidratato. L'EGA dimostra: pH:7,27, PaCO2: 26, PaO2: 95, HCO3- 14, Cl 115, K 3,0, Na 141.
È un disordine dell'equilibrio acido base per cui si ha una diminuzione di HCO3- ed una diminuzione del pH. Trattasi quindi di una acidosi metabolica ipercloremica (a normale anion gap) Il compenso sarà respiratorio per mezzo di un aumento della ventilazione. Nella pratica il compenso sarà immediato, quindi il vettore del rapporto pH/HCO3-, dell'immagine, sarà unico come sommatoria dei due vettori separati.
Regola del compenso: per 1 mmHg di riduzione di HCO3-, si ha una riduzione di 1-1,3 mmHg di CO2.
| pH | PaCO2 | HCO3- | |
|---|---|---|---|
| Acidosi metabolica | basso | basso | basso |
Anion gap
[modifica]Anion gap = Na+-(HCO3- + Cl-) = 12 +/- 4.
La somma delle cariche è fornito da Na+, K+, H+, Cl-, HPO42-, HSO42-, proteine sieriche-.
Questa differenza è uguale a 16 mEq/L.
Normalmente non si considerano HPO42-, HSO42- che sono peralro di difficile dosaggio.
In corso di acidosi da perdita di bicarbonati (diarrea), la perdita di anioni è rimpiazzata da un aumento di Cl- (acidosi metabolica ipercloremica ad anion gap normale).
In corso di acidosi da assunzione o accumulo di acidi (acido lattico, salicilati, glicoletilenico) i bicarbonati si riducono pari all'aumento di anion gap (acidosi metabolica normocloremica ad anion gap aumentato).
Infatti gli acidi (H+A-) vengono tamponati dai bicarbonati con consumo degli stessi (la reazione esatta è CO2 + H2O ⇄ H2CO3 ⇄ HCO3- + H+ come formula 2), la CO2 viene eliminata con l'iperventilazione.
Poiché questi acidi (Anioni A-) non sono normalmente dosabili, dobbiamo immaginarli in base all'aumento dell'anion gap.
Mnemonicamente l'aumento dell'anion gap significa la presenza di aumentati acidi nel plasma da autoproduzione (corpi chetonici, acido lattico...) o da assorbimento esogeno (acido acetilsalicilico, paraldeide, ecc).
L'importanza dell'anion gap è basilare, in quanto oltre a permetterci di differenziare tra acidosi inorganiche (tipicamente da insufficienza renale o da diarrea) ed acidosi organiche (diabete, alcoolismo, lattica , da tossici come paraldeide...), ci dice molto riguardo al successo del sodio bicarbonato nella terapia, positivo nella acidosi ipercloremica, meno positiva nell'acidosi normocloremica.[1] Inoltre è bene guardare anche il Λ A.G. ed il Λ HCO3-.
Infatti, ovviamente:
- nelle acidosi da apporto di acidi, l'A.G. aumenta edi bicarbonati calano;
- nelle acidosi da perdita di bicarbonati i bicarbonati calano, ma l'A.G. rimane uguale.
| Normale | A.G immodificato | A.G aumentato | |
|---|---|---|---|
| Na | 140 | 140 | 140 |
| Cl | 105 | 115 | 105 |
| HCO3 | 25 | 15 | 15 |
| A.G. | 10 | 10 | 20 |
| Λ HCO3 | 0 | -10 | -10 |
| Λ A.G. | 0 | 0 | +10 |
Nella realtà esistono anche situazioni miste.
Disordini misti
[modifica]I disordini misti si hanno quando ricorrono 2 o 3 disturbi semplici dell'equilibrio acido base.
Tutte le combinazioni possono coesistere eccetto l'alcalosi e l'acidosi respiratoria assieme (per ovvi motivi vista la stessa genesi).
Occorre pensare ad un disordine misto se:
- PH normale con PaCO2 e/o HCO3- fuori dai range (con l'unica eccezione dell'alcalosi respiratoria);
- Un disordine apparentemente semplice in cui non è rispettata la regola del compenso atteso;
- Quando sia presente una differenza tra il delta HCO3- ed il delta anion gap. ovvero quando per ogni aumento di anion gap non vi sia una equivalente riduzione di HCO3-.
Le possibilità sono:
- Acidosi respiratoria ed alcalosi metabolica;
- Acidosi respiratoria con acidosi metabolica ad anion gap aumentato, per esempio acidosi respiratoria a cui si aggiunge un'acidosi metabolica normocloremica (ad anion gap aumentato quindi) da intossicazione di acido lattico. Un esempio potrebbe essere un uomo giunto in un P.S. per edema polmonare acuto. La PA: 180/100Fr: 40/min., ega: pH:7,16, PaCO2:53, HCO3-:16., PaO2 :27, Na:138, K: 5,0, Cl: 100;
- Acidosi metabolica ed alcalosi respiratoria;
- Alcalosi respiratoria ed alcalosi metabolica;
- Acidosi metabolica ed alcalosi metabolica (ad esempio un cso di vomito incoercibile in un diabetico;
- Acidosi metabolica mista (ad elevato anion gap e normale anion gap).
Interpretazione rapida dell'emogasanalisi
[modifica]1) Guardare il pH: è normale? Siamo in acidosi? Siamo in alcalosi?
2) Guardare la PaCO2:
- se PaCO2 alta → ipoventila, quindi abbiamo o acidosi respiratoria primitiva o alcalosi metabolica con compenso respiratorio;
- se PaCO2 bassa → iperventila, quindi abbiamo o alcalosi respiratoria primitiva o acidosi metabolica con compenso respiratorio.
3) Guardare i bicarbonati:
| pH | PaCO2 | HCO3- | |
|---|---|---|---|
| Alcalosi respiratoria acuta o cronica | alto | basso | normale o basso |
| Alcalosi metabolica | alto | alto | alto |
| Acidosi respiratoria acuta o cronica | basso | alto | normale o alto |
| Acidosi metabolica | basso | basso | basso |
N.B. un'alterazione nel senso di aumento o diminuzione dei bicarbonati indica sempre o una alterazione metabolica, oppure respiratoria cronica con compenso metabolico. Ovvero se i bicarbonati sono normali ed il pH è modificato pensare sempre ad una acidosi od alcalosi respiratoria acuta.
4) Valutare sempre l'anion gap (non solo nel caso di acidosi metabolica che è di gran lunga la principale causa di aumento, in quanto potremmo trovarci davanti ad un disturbo misto).
Se alterazione anion gap per ogni unità di riduzione del pH vi deve essere una equivalente riduzione di HCO3 e viceversa. altrimenti ci troviamo di fronte ad un verosimile disturbo misto.
5) È rispettata la regola del compenso atteso?
- Acidosi respiratoria acuta: per 10 mmHg di aumento di PaCO2, si ha aumento di 1 mEq/L di HCO3-
- Acidosi respiratoria cronica: per 10 mmHg di aumento di PaCO2, si ha aumento di 3-4 mEq/l di HCO3-
- Alcalosi respiratoria acuta: per ogni 10 mmHg di riduzione di PaCO2, si ha consumo di 2 mEq/l di HCO3-
- Alcalosi respiratoria cronica: per 10 mmHg di riduzione di PaCO2, si ha un consumo di 5 mEq/l di HCO3-
6) Controllare sull'immagine dell'equilibrio acido base.
7) Ricordarsi sempre di ricercare le cause e di curare le cause, non solo il dato di laboratorio.
8) Ricordarsi sempre che moltissime cause di acidosi ed alcalosi metabolica hanno causa ed interesse chirurgico (occlusione intestinale bassa o alta).
Eziologia dell'alterazione dell'equilibrio acido base
[modifica]- Acidosi respiratoria → causata da ipoventilazione alveolare
- Alcalosi respiratoria → causata da iperventilazione alveolare:
- Iperventilazione volontaria,
- Ansia,
- Sepsi,
- Stimolo alla ventilazione di origine centrale (emorragia intracranica, lesioni cerebrali),
- Stimolo alla ventilazione di origine periferica (embolia polmonare, asma lieve).
- Acidosi metabolica con normale anion gap (e cloro alto):→
- Cause gastrointestinali
- Diarrea (i secreti pancreatici e del piccolo intestino hanno un pH di 8)
- Ureterosigmoidostomia
- Cause renali (insufficienza renale acuta, insufficienza renale cronica)
- Disordini ereditari del transfer del nefrone (tipo Fanconi...)
- Utilizzo di inibitori dell'anidrasi carbonica (acetazolamide)
- Utilizzo di risparmiatori di potassio (spironolattone, triamtirene, amiloride)
- Acidosi metabolica con aumentato anion gap (e cloro normale):→
- Acidosi lattica (la più frequinte acidosi)
- Acidosi uremica
- Digiuno
- Alcoolismo
- Insufficienza epatica
- Chetoacidosi diabetica
- Intossicazione da acido salicilico
- Intossicazione da paraldeiede
- Intossicazione da toluene
- Intossicazione da metanolo
- Intossicazione da glicoletilenico (liquido antigelo)
- Alcalosi metabolica
- Vomito incoercibile o drenaggio gastrico ripetuto.
- Contrazione del volume extracellulare
- Deplezione di potassio (si ha lo scambio trancellulare tra H e K con successivo aumento del riassorbimento renale di HCO3- e quindi alcalosi metabolica)
- Milk alkali syndrome (successiva ad eccessiva ingestione di bicarbonato nei pazienti con insufficienza renale)
- Alcalosi postipercapnica. Dopo un rapido ripristino della funzione respiratoria in un malato ipercapnico, si può avere una transitoria alcalosi metabolica, specialmente se il paziente ha anche un iperaldosteronismo secondario a scompenso cardiaco)
- Acidosi respiratoria ed alcalosi respiratoria
- BPCO con scompenso cardiaco dx in terapia con diuretici
- Acidosi respiratoria ed acidosi metabolica ad anion gap elevato
- Arresto cardiaco, grave ipossia con produzione di acido lattico
- Acidosi metabolica con alcalosi respiratoria
- Avvelenamento da ASA
- Cirrosi epatica con insufficienza renale
- Alcalosi respiratoria con alcalosi metabolica
- Pazienti in alcalosi respiratoria (sondino naso-gastrico a permanenza, sepsi, ipossiemia, dolore, farmaci) e contemporaneamente in alcalosi metabolica (sondino naso gastrico, vomito, ipovolemia, diuretici)
- Acidosi metabolica ed alcalosi metabolica
- Diarrea contemporanea a vomito
- Vomito o sondino nasogastrico durante acidosi lattica o chetoacidosi
- Acidosi metabolica mista (ad elevato anion gap e normale anion gap)
- Acidosi lattica o chetoacidosi contestuale a diarrea
Note
[modifica]- ↑ "Achille Guariglia, La terapia dei disordini dell'equilibrio Acido-Base
Bibliografia
[modifica]- (EN) Cecil, Textbook of medicine, 21ª ed., Saunders.
- (ES) Guyton, Tratado de Fisiologia Medica.
Altri progetti
[modifica] Wikipedia contiene informazioni sull'equilibrio acido-base
Wikipedia contiene informazioni sull'equilibrio acido-base Wikimedia Commons contiene immagini o altri file sull'equilibrio acido-base
Wikimedia Commons contiene immagini o altri file sull'equilibrio acido-base
Collegamenti esterni
[modifica]- Principi dell'equilibrio acido-base, anestit.unipa.it. (archiviato dall'url originale il ).


![{\displaystyle pH=-\log _{10}[H^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/645372dffba272d2e09a6da6aff7063616b46270)







![{\displaystyle {\textrm {K}}_{a}={\frac {[{\textrm {H}}^{+}][{\textrm {A}}^{-}]}{[{\textrm {HA}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/95f0179ceccd47a2ef36fbca19acf77cee21d7bc)
![{\displaystyle \log _{10}K_{{\ce {a}}}=\log _{10}\left({\frac {[{\ce {H+}}][{\ce {A^-}}]}{[{\ce {HA}}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36abce1718677bfab0bf4e23978b538e432f615e)
![{\displaystyle \log _{10}K_{{\ce {a}}}=\log _{10}[{\ce {H+}}]+\log _{10}\left({\frac {[{\ce {A^-}}]}{[{\ce {HA}}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/471f57ab2ccb0f022d8b79888f2d75c96d4fc1df)
![{\displaystyle -{\ce {p}}K_{{\ce {a}}}=-{\ce {pH}}+\log _{10}\left({\frac {[{\ce {A^-}}]}{[{\ce {HA}}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64894a433b4a4fab9a359d3b8446e5a2656d442)
![{\displaystyle \mathrm {pH} =\mathrm {p} K_{\mathrm {a} ~\mathrm {H} _{2}\mathrm {CO} _{3}}+\log _{10}\left({\frac {[\mathrm {HCO} _{3}^{-}]}{[\mathrm {H} _{2}\mathrm {CO} _{3}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/685aa0a31bd7e49cde0adc111e1c9276d74d165d)
![{\displaystyle [\mathrm {H} _{2}\mathrm {CO} _{3}]=k_{\rm {H~CO_{2}}}\,\times p_{\mathrm {CO} _{2}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0960e5502b82ca422a3b58bf8f91632886e67895)

![{\displaystyle \mathrm {pH} =6.1+\log _{10}\left({\frac {[\mathrm {HCO} _{3}^{-}]}{0.0307\times p_{\mathrm {CO} _{2}}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59929e7a57c2111e09b76dcbba2d15cc786a026c)